БИОЛОГИЧЕСКАЯ ХИМИЯ
Методический материал для самоподготовки)
Петрозаводск
ТЕМА 1. СТРОЕНИЕ, КЛАССИФИКАЦИЯ
И БИОЛОГИЧЕСКАЯ РОЛЬ АМИНОКИСЛОТ
Задание:
1. Выучить предложенный теоретический материал.
2. Ознакомиться с вариантами контрольной работы по теме.
(Выполнение контрольной работы по этой теме проводится на первом лабораторном занятии в 6-м семестре, во время летней сессии).
Аминокислотный состав белков
Историческая справка. Первая аминокислота – глицин была выделена в 1820 г. методом кислотного гидролиза желатины,полностью расшифрован аминокислотный состав белков в 1938 г., когда была идентифицирована последняя аминокислота – треонин (Имеются данные, что первым был выделен аспарагин из аспарагуса в 1806 г.).
Функции аминокислот. В настоящее время известно более 300 аминокислот, они могут выполнять разные функции:
· входят в состав всех белков – их 20, и такие аминокислоты называют стандартными, или протеиногенными ;
· входят в состав только редких, или определённых, белков (например, оксипролин, 5-оксилизин входят в состав коллагена; десмозин – в состав эластина);
· входят в состав других соединений (например, b-аланин входит в состав витамина В 3 , который необходим для синтеза КоА-SH);
· являются промежуточными метаболитами обменных процессов (например, орнитин, цитруллин);
· необходимы для синтеза биологически активных соединений, например, биогенных аминов, нейромедиаторов;
· необходимы для синтеза азотсодержащих соединений (полиаминов, нуклеотидов и нуклеиновых кислот);
· углеродный скелет аминокислот может использоваться для синтеза других соединений:
а) глюкозы – такие аминокислоты называются глюкогенными (большинство из протеиногенных);
б) липидов – кетогенными (вал, лей, иле, фен, тир);
· аминокислоты могут быть источником определенных функциональных групп – сульфатной (цистеин), одноуглеродных фрагментов (метионин, глицин и серин), аминогруппы (глутамин, аспарат).
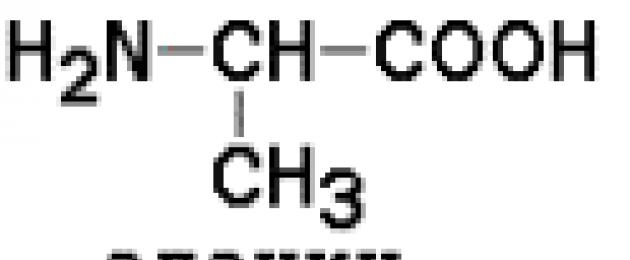
Номенклатура аминокислот. Аминокислоты – производные карбо-новых кислот, в молекуле которых атом водорода у С, стоящего в a-положении, замещён аминогруппой. Общая формула L-изомеров аминокислот:
Отличаются аминокислоты между собой функциональными группами в боковой цепи (R). Каждая аминокислота имеет тривиальное, рациональное и сокращенное трех- или однобуквенное обозначение , например, глицин, аминоуксусная, гли.
Тривиальное название чаще всего связано с источником выделения или свойствами аминокислоты:
· серин входит в состав фиброина шелка (от лат. serius – шелковистый),
· тирозин впервые выделен из сыра (от греч. tyros – сыр),
· глутамин выделен из клейковины злаковых (от лат. gluten – клей),
· цистин – из камней мочевого пузыря (от греч. kystis – пузырь),
· аспарагиновая кислота – ростков спаржи (от лат. asparagus – спаржа),
· глицин от греч. glykos – сладкий.
Рациональное название складывается исходя из того, что каждая аминокислота является производной соответствующей карбоновой кислоты.
Сокращенное обозначение используют для написания аминокислотного состава и последовательности аминокислот в цепи. В биохимии чаще всего применяют тривиальное и сокращенное обозначение.
Классификация аминокислот.
Существует несколько классификаций:
1) по химической природе боковой цепи (R),
2) рациональная классификация (по степени полярности радикала, по Ленинджеру),
3) по способности синтезироваться в организме.
По химической природе боковой цепи (R) все аминокислоты делятся на:
Ациклические (алифатические):
· моноаминомонокарбоновые
· моноаминодикарбоновые
· диаминомонокарбоновые
· диаминодикарбоновые
Циклические:
1) гомоциклические (фен, тир);
2) гетероциклические :
· аминокислоты (гис, три);
· иминокислоты (про).
По Ленинджеру (по способности радикала взаимодействовать с водой) все аминокислоты делят на 4 группы:
· неполярные , незаряженные (гидрофобные ) – их 8: ала, вал, лей, иле, мет, фен, три, про;
· полярные , незаряженные (гидрофильные ) – их 7: сер, тре, глн, асн, цис, тир, гли;
· отрицательно-заряженные – их 2: асп, глу;
· положительно-заряженные – их 3: гис, арг, лиз.
По способности синтезироваться в организме аминокислоты могут быть:
· заменимыми , которые могут синтезироваться в организме;
· незаменимыми , которые не могут синтезироваться в орга-низме и должны поступать с пищей.
Понятие «незаменимые» относительно для каждого вида – у человека и свиней их 10 (вал, лей, иле, тре, мет, фен, три, арг, гис, лиз), у животных с четырехкамерным желудком – 2 серосодержащие (цис, мет), у птиц – 1 (гли).
Физико-химические свойства аминокислот:
1. Растворимы в воде (лучше растворимы положительно- и отрицательно заряженные аминокислоты, затем гидрофиль-ные, хуже – гидрофобные).
2. Имеют высокую точку плавления (обусловлено тем, что в кристаллическом виде находятся в виде биполярных ионов).
3. Обладают оптической активностью, которая обусловлена наличием асимметрического атома углерода(за исключением гли). В связи с этим аминокислоты:
· существуют в виде L- и D-стереоизомеров, но в состав белков высших животных входят в основном аминокислоты L-ряда; количество стереоизомеров зависит от количестваасимметрических атомов углерода и рассчитывается по формуле 2 n , где n – количество асимметрических атомов С;
· способны вращать плоскость поляризованного света вправо или влево; величина удельного вращения у разных аминокислот варьирует от 10 до 30 º .
4. Амфотерные свойства (аминокислоты, кроме гли, при физиологических значениях рН и в кристаллическом виде находятся в виде биполярных ионов). Величина рН, при которой суммарный заряд аминокислоты равен 0, называется изоэлектрической точкой. Для моноаминомонокарбоновых аминокислот она лежит в интервале 5,5-6,3, диаминомоно-карбоновых – больше 7, для дикарбоновых – меньше 7.
5. Химические свойства :
· кислотные свойства, обусловленные наличием карбоксильной группы;
· основные свойства, обусловленные наличием аминогруппы;
· свойства, обусловленные взаимодействием амино-
и карбоксильной групп между собой;
· свойства, обусловленные наличием функциональных групп в боковой цепи.
 |  |
|
 |  |  |
Полярные (гидрофильные) аминокислоты
Отрицательно заряженные аминокислоты
В некоторых белках содержатся специфические производные аминокислот . В коллагене (белке соединительной ткани) обнаружены оксипролин и оксилизин. Основой структуры гормонов щитовидной железы является дийодтирозин – производное тирозина.


Общим свойством аминокислот является амфотерность (от греч amphoteros - двусторонний). В интервале рН 4,0-9,0 почти все аминокислоты существуют в форме биполяных ионов (цвиттерионов). Значение изоэлектрической точки аминокислоты (ИЭТ, рI) рассчитывается по формуле:
 .
.
рI для моноаминодикарбоновых кислот рассчитывается как полусумма значений рK (таблица 1) a- и w-карбоксильных групп, для диаминомонокарбоновых кислот – как полусумма значений рK a- и w-аминогрупп.
Существуют заменимые аминокислоты, которые могут быть синтезированы в организме человека, и незаменимые, которые в организме не образуются и должны поступать в составе пищи.
Незаменимые аминокислоты : валин, треонин, лейцин, лизин, метионин, триптофан, изолейцин, фенилаланин.
Заменимые аминокислоты: глицин, аланин, аспартат, аспарагин, глутамат, глутамин, серин, пролин.
Условно заменимые аминокислоты (могут синтезироваться в организме из других аминокислот): аргинин (из цитруллина), цистеин (из серина), тирозин (из фенилаланина), гистидин (при участии глутамина).
Относительное содержание различных аминокислот в белках неодинаково.
Для обнаружения аминокислот в биологических объектах и их количественного определения используют реакцию с нингидрином.
Таблица 1. Константы диссоциации аминокислот
| Аминокислота | pK 1 | pK 2 | pK 3 |
| Алании | 2,34 | 9,69 | |
| Аргинин | 2,18 | 9,09 | 13,2 |
| Аспарагин | 2,02 | 8,80 | |
| Аспарагиновая кислота | 1,88 | 3,65 | 9,60 |
| Валии | 2,32 | 9,62 | |
| Гистидин | 1,78 | 5,97 | 8,97 |
| Глицин | 2,34 | 9,60 | |
| Глутамин | 2,17 | 9,13 | |
| Глутаминовая кислота | 2,19 | 4,25 | 9,67 |
| Изолейцин | 2,26 | 9,62 | |
| Лейцин | 2,36 | 9,60 | |
| Лизин | 2,20 | 8,90 | 10,28 |
| Метионин | 2,28 | 9,21 | |
| Пролин | 1,99 | 10,60 | |
| Серии | 2,21 | 9,15 | |
| Тирозин | 2,20 | 9,11 | 10,07 |
| Треонин | 2,15 | 9,12 | |
| Триптофан | 2,38 | 9,39 | |
| Фенилаланин | 1,83 | 9,13 | |
| Цистеин | 1,71 | 8,33 | 10,78 |
СТРУКТУРНАЯ ОРГАНИЗАЦИЯ БЕЛКОВ
Существуют 4 основных уровня структурной организации белковых молекул.
Первичная структура белка – последовательность расположения остатков аминокислот в полипептидной цепи. Отдельные аминокислоты в белковой молекуле связаны друг с другом пептидными связями , образующимися при взаимодействии a-карбоксильных и a-аминогрупп аминокислот:
 .
.
В настоящее временя расшифрована первичная структура десятков тысяч различных белков. Первым этапом определения первичной структуры белка является установление аминокислотного состава методами гидролиза. Затем определяют химическую природу концевых аминокислот. Следующий этап - определение последовательности аминокислот в полипептидной цепи, для чего применяют частичный избирательный (ферментативный либо химический) гидролиз.
СТРОЕНИЕ, СВОЙСТВА И КЛАССИФИКАЦИЯ АМИНОКИСЛОТ И БЕЛКОВ
Аминокислоты по строению они являются органическими карбоновыми кислотами, у которых, как минимум, один атом водорода замещен на аминогруппу. Они являются строительными блоками белковых молекул, но необходимость их изучения кроется не только в данной функции.
Несколько из аминокислот являются источником для образования нейромедиаторов в ЦНС (гистамин, серотонин, гамма-аминомасляная кислота, дофамин, норадреналин), другие сами являются нейромедиаторами (глицин, глутаминовая кислота).
Те или иные группы аминокислот необходимы для синтеза пуриновых и пиримидиновых оснований без которых нет нуклеиновых кислот, используются для синтеза низкомолекулярных биологически важных соединений (креатин, карнитин, карнозин, ансерин и др.).
Аминокислота тирозин целиком входит в состав гормонов щитовидной железы и мозгового вещества надпочечников .
С нарушением обмена аминокислот связан ряд наследственных и приобретенных заболеваний , сопровождающихся серьезными проблемами в развитии организма (цистиноз, гомоцистеинемия, лейциноз, тирозинемии и др). Самым известным примером является фенилкетонурия.
КЛАССИФИКАЦИЯ АМИНОКИСЛОТ
Из-за разнообразного строения и свойств классификация аминокислот может быть различной, в зависимости от выбранного качества аминокислот. Аминокислоты делятся:
1. В зависимости от положения аминогруппы.
2. По абсолютной конфигурации молекулы.
3. По оптической активности.
4. По участию аминокислот в синтезе белков.
5. По строению бокового радикала.
6. По кислотно-основным свойствам.
7. По необходимости для организма.
По абсолютной конфигурации молекулы
По абсолютной конфигурации молекулы выделяют D- и L-формы. Различия между изомерами связаны с взаимным расположением четырех замещающих групп, находящихся в вершинах воображаемого тетраэдра, центром которого является атом углерода в α -положении.
В белке любого организма содержится только один изомер, для млекопитающих это L-аминокислоты. Однако оптические изомеры претерпевают самопроизвольную неферментативную рацемизацию , т.е. L-форма переходит в D-форму. Это обстоятельство используется для определения возраста, например, костной ткани зуба (в криминалистике, археологии).

В зависимости от положения аминогруппы
Выделяют α, β, γ и другие аминокислоты. Для организма млекопитающих наиболее характерны α -аминокислоты.
По оптической активности
По оптической активности аминокислоты делятся на право- и левовращающие.
Наличие ассиметричного атома углерода (хирального центра) делает возможным только два расположения химических групп вокруг него. Это приводит к особому отличию веществ друг от друга, а именно – изменению направления вращения плоскости поляризации поляризованного света, проходящего через раствор. Величину угла поворота определяют при помощи поляриметра. В
соответствии с углом поворота выделяют правовращающие (+) и левовращающие (–) изомеры.
Деление на L- и D-формы не соответствует делению на право- и левовращающие. Для одних аминокислот L-формы (или D-формы) являются правовращающими, для других – левовращающими. Например, L-аланин – правовращающий, а L-фенилаланин – левовращающий. При смешивании L- и D-форм одной аминокислоты образуется рацемическая смесь, не обладающая оптической активностью.
По участию аминокислот в синтезе белков
Выделяют протеиногенные (20 АК) и непротеиногенные (около 40 АК). Все протеиногенные аминокислоты являются α -аминокислотами.
На примере протеиногенных аминокислот можно показать дополнительные способы классификации:
o по строению бокового радикала – неполярные (алифатические, ароматические) и полярные (незаряженные, отрицательно и положительно заряженные),
o электрохимическая – по кислотно-основным свойствам подразделяют нейтральные (большинство), кислые (Асп, Глу) и основные (Лиз, Арг, Гис) аминокислоты,
o физиологическая классификация – по необходимости для организма выделяют незаменимые (Лей, Иле, Вал, Фен, Три, Тре, Лиз, Мет) и заменимые. Две аминокислоты являются условно незаменимыми (Арг, Гис), т.е.их синтез происходит в недостаточном количестве.
Аминокислоты классифицируются несколькими способами в зависимости от признака, по которому происходит их деление на группы. Принято в основном три классификации аминокислот: структурная - по строению бокового радикала; электрохимическая - за кислото-щелочными свойствами аминокислот; биологическая (физиологическая) - по мере незаменимости аминокислот для организма.
Согласно общей формулы a-аминокислоты отличаются только строением R, согласно чем они делятся на алифатические (ациклические), циклические (см. схему). Каждая группа подразделяется на подгруппы. Так, аминокислоты алифатического ряда в зависимости от количества амино-и карбоксильных групп делятся на моноаминомонокарбонови, диаминомонокарбонови, моноаминоды-карбоновые, диаминодикарбонови. Некоторые аминокислоты, уже входя в состав белков, могут модифицироваться, т.е. испытывать определенные химических превращений, которые приводят к изменению в структуре радикала. Они не принимают непосредственного участия в синтезе белков. Но их можно найти в гидролизате белков. Так, в результате процесса гидроксилирования, который происходит в организме, в боковые радикалы лизина и пролина белка коллагена вводятся ОН-группы с образованием гидроксилизину и гидроксипролина.
Этот процесс имеет место при взаимодействии цистеиновых остатков в полипептидной цепи: как внутри его, так и между полипептидными-ми цепями наблюдается при формировании пространственной конформации белковой молекулы.
По электрохимическими (кислотно-щелочными) свойствами аминокислоты зависимости от количества NH2-и СООН-групп в молекуле делятся на три группы: кислые - с дополнительными карбоксильными группами в боковом радикале (моноаминодикарбонови кислоты: аспарагиновая и глутаминовая) щелочные - диаминомонокарбонови (лизин, аргинин) и гистидин; нейтральные - остальные аминокислот, в которых боковой радикал не проявляет ни кислых, ни щелочных свойств. Некоторые авторы считают, что в цистеина и тирозина сульфгидрильных и гидроксильная группы в боковом радикале имеют слабо кислые свойства.
Современная рациональная классификация аминокислот основана на полярности радикалов, т.е. способности их к взаимодействию с водой при физиологических значениях рН (около рН 7,0). Она включает 4 класса аминокислот:
Неполярные (гидрофобные), боковые радикалы которых не имеют родства с водой. К ним относятся аланин, валин, лейцин, изолейцин, метионин, фенилаланин, триптофан, пролин;
Полярные (гидрофильные) незаряженные - глицин, серин, треонин, цистеин, тирозин, аспарагин, глутамин;
Полярные отрицательно заряженные - аспарагиновая и глутаминовая кислоты;
Полярные положительно заряженные - лизин, аргинин, гистидин.
По биологическим (физиологическим) значением аминокислоты подразделяют на три группы:
Незаменимые, которые не могут синтезироваться в организме из других соединений, поэтому должны обязательно поступать с пищевыми продуктами. Это незаменимые добавки пищи. Незаменимых аминокислот для человека восемь: трео-нин, метионин, валин, лейцин, изолейцин, лизин, фенилаланин и триптофан;
Напивзаминни аминокислоты могут образовываться в организме, но не в достаточном количестве, поэтому частично должны поступать с пищей. Для человека такими аминокислотами являются аргинин, тирозин, гистидин;
Заменимые аминокислоты синтезируются в организме в достаточном количестве из незаменимых аминокислот и других соединений. К ним относится остальные аминокислот. Приведенная биологическая классификация аминокислот не является универсальной в отличие от предыдущих и в определенной степени условна, так как зависит от вида организма. Однако абсолютное незаменимость восьми аминокислот является универсальной для всех видов организмов.
1. Неполярные аминокислоты (аланин, валин, лейцин, изолейцин, метионин, фенилаланин, триптофан, пролин). Эти аминокислоты гидрофобны. Имеют незаряженный радикал. При сближении в пространстве радикалы этих аминокислот обеспечивают гидрофобное взаимодействие .


2. Полярные, гидрофильные, незаряженные аминокислоты (глицин, треонин, цистеин, тирозин, серин, аспарагин, глутамин). Содержат такие полярные функциональные группы как гидроксильная, сульфгидрильная и амидогруппа. При сближении в пространстве радикалы этих аминокислот образуют водородные связи . Связанные дисульфидной связью два остатка цистеина называют цистином.


3. Кислые аминокислоты (отрицательно заряженные аминокислоты) имеют отрицательный заряд (аспарагиновая и глутаминовая кислоты) при рН 7,0

4. Основные аминокислоты (положительно заряженные аминокислоты) имеют положительный заряд при рН 7,0.

Радикалы аминокислот 3 и 4 групп участвуют в образовании ионных связей .
Аминокислоты классифицируются на заменимые и незаменимые (эссенциальные).
1. Незаменимые (эссенциальные) аминокислоты не могут синтезироваться в организме и должны поступать с пищей. Они необходимы для обеспечения и поддержания роста: аргинин, валин, гистидин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин (шесть аминокислот 1-й группы, одна – второй и три – четвертой).
2. Заменимые аминокислоты. Организм может синтезировать около 10 аминокислот для обеспечения биологических потребностей, поэтому поступление их с пищей не обязательно (аланин, аспарагин, аспарагиновая кислота, цистеин, глутаминовая кислота, глутамин, глицин, пролин, серин, тирозин).
Аминокислоты, связанные пептидной связью, образуют полипептидную цепь и каждая аминокислота в ней называется аминокислотный остаток . В полипептиде выделяют N-конец (терминальная альфа-аминогруппа) и С-конец (терминальная альфа-карбоксильная группа). Большинство природных полипептидных цепей, содержащих от 50 до 2000 аминокислотных остатков, называют белками (протеинами). Полипептидные цепи меньшей длины называют олигопептидами или просто пептидами. В некоторых белках полипептидные цепи связываются поперечными дисульфидными связями, образованными окислением двух остатков цистеина. Внеклеточные белки часто содержат дисульфидные связи, а внутриклеточные белки часто утрачивают их. В некоторых белках образуются поперечные связи при взаимодействии радикалов других аминокислотных остатков (коллаген, фибрин).